séparation selon la taille
- chromatographie par gel filtration:
Principe:
des billes sphériques et poreuses remplissent une colonne de chromatographie. Ces billes peuvent être composées d'agarose, de polyacrylamide ou de dextran. Les billes ont de concentrations plus ou moins différentes dont le diamètre des pores varie.
des billes sphériques et poreuses remplissent une colonne de chromatographie. Ces billes peuvent être composées d'agarose, de polyacrylamide ou de dextran. Les billes ont de concentrations plus ou moins différentes dont le diamètre des pores varie.
Le volume total de gel introduit dans la colonne (que l'on note VT) comprend
- le volume extérieur aux billes (V0), appelé « Volume Mort »;
-le volume libre a l'intérieur des billes Vi;
- le volume occupé par la matière constituant les billes Vg.
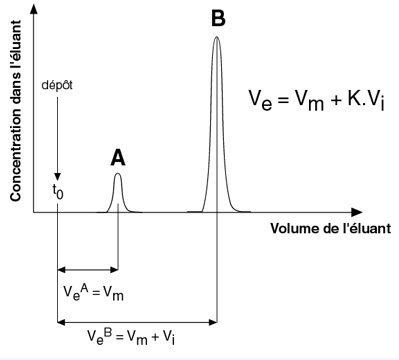
-Le volume d'élution Ve correspond au volume de phase mobile nécessaire pour récupérer un composé après son dépôt sur le gel.
Le volume mort V0 est déterminé par la mesure du Ve d'un composé dont la masse
moléculaire est supérieur à la taille du pores .
Lorsque le mélange de composés passe à travers la colonne, les molécules se distribuent entre V0 et Vi en fonction de leur capacité à pénétrer dans le spores des billes (càd en fonction de leur taille).
Plus la molécule est grosses, plus elle aura des difficultés à pénétrer dans les pores, elle est donc exclue le premier de la colonne et se retrouve dans la première fraction d'élution. avec un volume d'élution: Ve=V0
Plus la molécule est petite , plus elle pourra pénétrer dans les différents pores des billes ce qui va la ralentir dans la colonne et donc elle sortira avec un volume d'élution plus important : Ve=V0+Vi
Si la molécule est de taille moyen , comparable au diamètre du pores, sa répartition entre les phases externes et les phases internes est donnée par un coefficient dit « coefficient de distribution »
KD = (Ve – V0 ) / Vi
Donc le volume d'élution est calculé comme la suite: Ve=V0+K.Vi
diagramme d'élution des substances A et B
|
|
- éléctrophorése SDS-page :
définition:
- PAGE: poly-acrylamide gel c'est le support dans lequel les vont être mise en mouvement.
- SDS: soduim dodecyl-sulfate c'est un détergent anionique utilisé pour dénaturé et chargé négativement le protéine de notre échantillon
- βME: beta-mercaptoéthanol c'est un agent réducteur pour empêcher la dénaturation du protéine.
Le SDS interagissent avec le protéine grâce a sa queue hydrophobe . par sa charge négative favorise la migration du complexe [ protéine-SDS ] vers l'électrode positive .
La mobilité des protéines est inversement proportionnelle a sa masse molaire (MM).








0 Commentaires